|
UDI新節(jié)點(diǎn)!第一批醫(yī)療器械唯一標(biāo)識(shí)2021年1月1日起實(shí)施!时间:2020-11-10 作者:依瑪仕青島Lily【转载】 阅读 UDI新節(jié)點(diǎn)!第一批醫(yī)療器械唯一標(biāo)識(shí)2021年1月1日起實(shí)施! 9月30日,國(guó)家藥監(jiān)局、國(guó)家衛(wèi)健委、國(guó)家醫(yī)保局聯(lián)合發(fā)布《關(guān)于深入推進(jìn)試點(diǎn)做好第一批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作的公告》(以下簡(jiǎn)稱《公告》),決定將唯一標(biāo)識(shí)系統(tǒng)試點(diǎn)時(shí)間延長(zhǎng)至2020年12月31日,第一批實(shí)施工作由2020年10月1日調(diào)整至2021年1月1日。
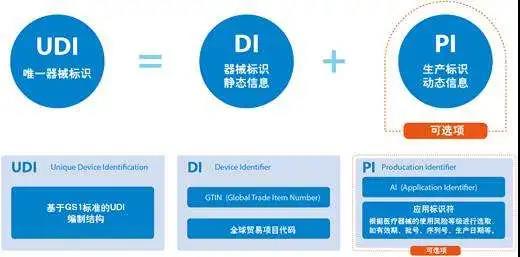
《公告》提出要深入推進(jìn)唯一標(biāo)識(shí)試點(diǎn)工作,在現(xiàn)有試點(diǎn)品種的基礎(chǔ)上,以自愿原則,鼓勵(lì)企業(yè)將更多品種,《第一批國(guó)家高值醫(yī)用耗材重點(diǎn)治理清單》(以下簡(jiǎn)稱《清單》)中的產(chǎn)品納入試點(diǎn)范圍。 2019年7月,我國(guó)醫(yī)療器械唯一辨識(shí)系統(tǒng)試點(diǎn)工作正式啟動(dòng),共分5個(gè)階段。據(jù)了解,醫(yī)療器械唯一標(biāo)識(shí)(簡(jiǎn)稱UDI)是醫(yī)療器械產(chǎn)品身份證,是醫(yī)療器械的“國(guó)際語(yǔ)言”。作為國(guó)際通行做法,歐美等國(guó)家和地區(qū)均在積極推進(jìn)UDI系統(tǒng)。
多年來(lái),我國(guó)業(yè)界持續(xù)呼吁建立UDI系統(tǒng),為每一個(gè)醫(yī)療器械賦予身份證,實(shí)現(xiàn)生產(chǎn)、經(jīng)營(yíng)、使用各環(huán)節(jié)的透明化、可視化,提升產(chǎn)品的可追溯性。 2019年5月23日,國(guó)務(wù)院辦公廳印發(fā)的《深化醫(yī)藥衛(wèi)生體制改革2019年重點(diǎn)工作任務(wù)》中就明確要將制定醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)規(guī)則推動(dòng)落實(shí)的重點(diǎn)工作之一。文件要求,逐步統(tǒng)一全國(guó)醫(yī)保高值醫(yī)用耗材分類與編碼。對(duì)單價(jià)和資源消耗占比相對(duì)較高的高值醫(yī)用耗材開展重點(diǎn)治理。
2019年7月1日,國(guó)家藥監(jiān)局綜合司、國(guó)家衛(wèi)健委聯(lián)合發(fā)文,我國(guó)醫(yī)療器械唯一辨識(shí)系統(tǒng)試點(diǎn)工作正式啟動(dòng)。首批試點(diǎn)重點(diǎn)品種為心臟、顱腦植入物、假體類等高風(fēng)險(xiǎn)植(介)入類醫(yī)療器械。試點(diǎn)工作從2019年7月正式啟動(dòng),共分5個(gè)階段實(shí)施。 第一階段:2019年7月,確定試點(diǎn)品種、參與單位。 第二階段:2019年8月—11月,組織驗(yàn)證醫(yī)療器械唯一標(biāo)識(shí)的創(chuàng)建和賦予。 第三階段:2019年12月—2020年2月,組織驗(yàn)證醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)的上傳、下載和接口標(biāo)準(zhǔn)。 第四階段:2020年3月—6月,組織驗(yàn)證唯一標(biāo)識(shí)數(shù)據(jù)的部門間銜接和擴(kuò)展應(yīng)用。 第五階段:2020年7月,組織召開試點(diǎn)總結(jié)會(huì),形成試點(diǎn)報(bào)告,完善首批產(chǎn)品唯一標(biāo)識(shí)實(shí)施方案。 2019年12月10日,醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)于正式上線,面向試點(diǎn)企業(yè)開放針對(duì)試點(diǎn)品種的唯一標(biāo)識(shí)相關(guān)數(shù)據(jù)申報(bào)功能。 第一批唯一標(biāo)識(shí)實(shí)施工作具體安排 《公告》明確試點(diǎn)期間,企業(yè)可向醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)上傳、維護(hù)和更新相關(guān)數(shù)據(jù),各相關(guān)方可通過(guò)唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)共享應(yīng)用相關(guān)數(shù)據(jù),醫(yī)療機(jī)構(gòu)可積極探索唯一標(biāo)識(shí)與醫(yī)療器械管理、臨床應(yīng)用、醫(yī)保結(jié)算等領(lǐng)域的銜接應(yīng)用。 試點(diǎn)結(jié)束后,將全面啟動(dòng)第一批唯一標(biāo)識(shí)實(shí)施工作。 實(shí)施時(shí)間:第一批實(shí)施時(shí)間由2020年10月1日調(diào)整至2021年1月1日。 實(shí)施品種:在《國(guó)家藥監(jiān)局關(guān)于做好第一批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作有關(guān)事項(xiàng)的通告》(2019年第72號(hào))9大類64個(gè)品種的基礎(chǔ)上,將《清單》中耳內(nèi)假體、脊柱椎體間固定/置換系統(tǒng)、可吸收外科止血材料、陰莖假體、植入式藥物輸注設(shè)備等5種高風(fēng)險(xiǎn)第三類醫(yī)療器械納入第一批實(shí)施唯一標(biāo)識(shí)的品種范圍。鼓勵(lì)《清單》中其他品種第一批實(shí)施唯一標(biāo)識(shí)。 注意:除實(shí)施時(shí)間和實(shí)施品種調(diào)整外,其余實(shí)施要求不變。 有關(guān)要求: 1.各省(區(qū)、市)藥品監(jiān)督管理局要高度重視唯一標(biāo)識(shí)實(shí)施工作,積極開展唯一標(biāo)識(shí)政策宣貫培訓(xùn),做好試點(diǎn)工作指導(dǎo),盡快摸清行政區(qū)域內(nèi)第一批實(shí)施唯一標(biāo)識(shí)的企業(yè)情況,結(jié)合工作實(shí)際制定相應(yīng)工作方案,組織好轄區(qū)內(nèi)第一批實(shí)施工作。 2.第一批實(shí)施唯一標(biāo)識(shí)的醫(yī)療器械注冊(cè)人于2021年1月1日起,嚴(yán)格按照《醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)規(guī)則》等有關(guān)要求開展產(chǎn)品賦碼、數(shù)據(jù)上傳和維護(hù)等工作,并對(duì)數(shù)據(jù)真實(shí)性、準(zhǔn)確性、完整性負(fù)責(zé)。 3.醫(yī)療器械唯一標(biāo)識(shí)實(shí)施各相關(guān)方要充分利用唯一標(biāo)識(shí)開展工作,重點(diǎn)推進(jìn)唯一標(biāo)識(shí)在醫(yī)藥、醫(yī)療、醫(yī)保等領(lǐng)域的銜接應(yīng)用。各方在實(shí)施過(guò)程中應(yīng)當(dāng)及時(shí)分析、總結(jié),重要問(wèn)題和建議及時(shí)報(bào)告,確保唯一標(biāo)識(shí)實(shí)施工作順利推進(jìn)。 更多UDI賦碼問(wèn)題,歡迎致電依瑪仕青島服務(wù)專線0532-80928335. 青島噴碼機(jī)廠家 山東青島噴碼機(jī) UDI噴碼機(jī) 文章來(lái)源:http://ejinnuo.com/detai1228/vip_doc/18866488.html |







 魯公網(wǎng)安備37021402001065號(hào)
魯公網(wǎng)安備37021402001065號(hào)